Hits: 1893
@可能用到的相对原子质量:C:12 O:16 Na:23 Cl:35.5 Cu:64 Zn:65 Ag:108
一、单选题(本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。)
1.关于金属腐蚀的叙述中,正确的是( )
A. 金属被腐蚀的本质是M+nH2O===M(OH)n+ ![]() H2↑
H2↑
B. 马口铁(镀锡铁)镀层破损后被腐蚀时,首先是镀层被氧化
C. 金属在一般情况下发生的电化学腐蚀主要是吸氧腐蚀
D. 常温下,置于空气中的金属主要发生化学腐蚀
2.利用电解法可将含有Fe、Zn、Ag、Au等杂质的粗铜提纯,下列叙述正确的是( )
A. 电解时以纯铜作阳极
B. 电解时阳极发生还原反应
C. 纯铜连接电源负极,其电极反应式是Cu-2e-===Cu2+
D. 电解后,电解槽底部会形成含少量Ag、Au等金属的阳极泥
3.下列各选项中两个反应的反应热,其中ΔH1>ΔH2的是( )
A. 2H2(g)+O2(g)===2H2O(g) ΔH1;2H2(g)+O2(g)===2H2O(l) ΔH2
B. 4P(g)+5O2(g)===2P2O5(g) ΔH1;4P(s)+5O2(g)===2P2O5(g) ΔH2
C. 2SO2(g)+O2(g) ![]() 2SO3(g) ΔH1;2SO3(g)
2SO3(g) ΔH1;2SO3(g) ![]() O2(g)+2SO2(g) ΔH2
O2(g)+2SO2(g) ΔH2
D. 已知反应:C(金刚石,s)===C(石墨,s) ΔH<0。C(金刚石,s)+O2(g)===CO2(g) ΔH1;C(石墨,s)+O2(g)===CO2(g) ΔH2
4.某原电池装置如图所示,电池总反应为2Ag+Cl2 ![]() 2AgCl。下列说法正确的是 ( )
2AgCl。下列说法正确的是 ( )
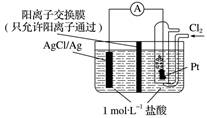
A. 正极反应为AgCl+e-===Ag+Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
5.已知25 ℃、101 kPa条件下:
(1)4Al(s)+3O2(g)===2Al2O3(s) ΔH=-2 834.9 kJ·mol-1
(2)4Al(s)+2O3(g)===2Al2O3(s) ΔH=-3 119.1 kJ·mol-1
由此得出的正确结论是( )
A. 等质量的O2比O3能量低,由O2变为O3为吸热反应
B. 等质量的O2比O3能量高,由O2变为O3为放热反应
C. O3比O2稳定,由O2变为O3为吸热反应
D. O2比O3稳定,由O2变为O3为放热反应
6.有关甲、乙、丙、丁四个图示的叙述正确的是( )
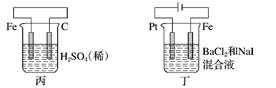

A. 甲中负极反应式为2H++2e-===H2↑
B. 乙中阳极反应式为Ag++e-===Ag
C. 丙中H+向碳棒方向移动
D. 丁中电解开始时阳极产生黄绿色气体
7.运用中和反应反应热的测定方法,即保温、隔热的条件下,向盛有20 mL 2.08 mol·L-1NaOH溶液的试管中分五次加入1~5 mL未知浓度的H2SO4溶液(边加边振荡,每次加入1 mL)后,测得溶液的温度分别是1.4 ℃、2.5 ℃、4.2 ℃、5.2 ℃、5.18 ℃,则该硫酸溶液的物质的量浓度约是( )
A. 20.8 mol·L-1 B. 6.9 mol·L-1 C. 5.2 mol·L-1 D. 4.16 mol·L-1
8.已知:C(s)+O2(g)===CO(g) ΔH=-110.35 kJ·mol-1,CO(g)+O2(g)===CO2(g) ΔH=-282.57 kJ·mol-1。6 g碳不完全燃烧所得产物中,CO与CO2的体积比为2∶3,则与6 g碳完全燃烧相比,损失的热量为( )
A. 56.51 kJ B. 110.35 kJ C. 196.46 kJ D. 282.57 kJ
9.下列关于如图所示的实验装置的判断中错误的是( )
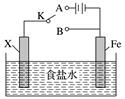
A. 若X为碳棒,开关K置于A处可减缓铁的腐蚀
B. 若X为锌棒,开关K置于A或B处均可减缓铁的腐蚀
C. 若X为锌棒,开关K置于B处时,为牺牲阳极的阴极保护法
D. 若X为碳棒,开关K置于B处时,铁电极上发生的反应为2H++2e-===H2↑
10.火星大气中含有大量,一种有参加反应的新型全固态电池有望为火星探测器供电。该电池以金属钠为负极,碳纳米管为正极,放电时
A.负极上发生还原反应 B.在正极上得电子
C.阳离子由正极移向负极 D.将电能转化为化学能
二、不定项选择(本题共5小题,每小题4分,共20分。每小题有一个或2个选项符合题目要求,全部选对的4分,选对但不全的得2分,有选错的得0分。)
11.黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为
S(s)+2KNO3(s)+3C(s)===K2S(s)+N2(g)+3CO2(g) ΔH=xkJ·mol-1
已知:碳的燃烧热ΔH1=akJ·mol-1
S(s)+2K(s)===K2S(s) ΔH2=bkJ·mol-1
2K(s)+N2(g)+3O2(g)===2KNO3(s) ΔH3=ckJ·mol-1则x为( )
A. 3a+b-c B.c-3a-b
C.a+b-c D.c-a-b
12.如图中X、Y分别是直流电源的两极,通电后发现a电极质量增加,b电极处有无色气体放出,两烧杯的溶液相同。符合这一情况的是表中的
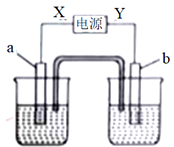
| 选项 | a | b | X | 溶液 |
| A | 锌 | 石墨 | 负极 | CuSO4 |
| B | 石墨 | 石墨 | 负极 | NaOH |
| C | 银 | 石墨 | 正极 | AgNO3 |
| D | 铜 | 石墨 | 负极 | CuCl2 |
A.A B.B C.C D.D
13.可以利用微生物电池除去废水中的乙酸钠和对氯酚( ![]() ),其原理如图所示。下列有关说法不正确的是
),其原理如图所示。下列有关说法不正确的是
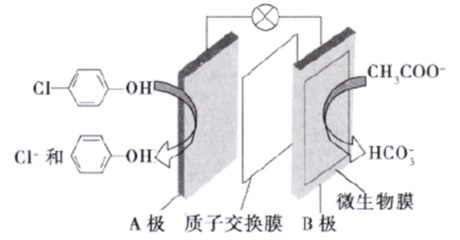
A.B极是负极
B.质子从A极移向B极
C.B极的电极反应式为CH3COO–-8e–+4H2O=2+9H+
D.处理后的废水升高
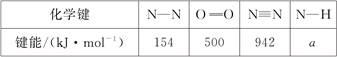
14.断裂1 mol化学键所需的能量如下:
火箭燃料肼(H2N—NH2)的有关化学反应的能量变化如图所示,则下列说法错误的是( )
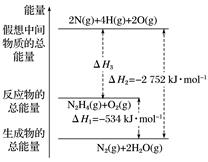
A. N2比O2稳定 B. N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
C. 表中的a=194 D. 图中的ΔH3=+2 218 kJ·mol-1
15.最近我国科学家设计了一种CO2+H2S协同转化装置,实现对天然气中CO2和H2S的高效去除。示意图如图所示,其中电极分别为ZnO@石墨烯(石墨烯包裹的ZnO)和石墨烯,石墨烯电极区发生反应为:
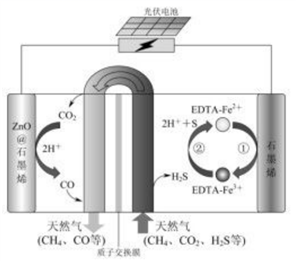
①EDTA-Fe2+-e–=EDTA-Fe3+
②2EDTA-Fe3++H2S=2H++S+2EDTA-Fe2+
该装置工作时,下列叙述错误的是
A.阴极的电极反应:CO2+2H++2e–=CO+H2O
B.协同转化总反应:CO2+H2S=CO+H2O+S
C.石墨烯上的电势比ZnO@石墨烯上的低
D.若采用Fe3+/Fe2+取代EDTA-Fe3+/EDTA-Fe2+,溶液需为酸性
三、非选择题(本题共5小题,共60分.)
16.某实验小组用100 mL 0.50 mol·L-1NaOH溶液与60 mL 0.50 mol·L-1硫酸溶液进行中和热的测定,装置如图所示。回答下列问题:
(1)若实验共需要400 mL NaOH溶液,实验室在配制该溶液时,则需要称量NaOH固体________ g。
(2)图中装置缺少的仪器是________。
(3)硫酸稍过量的原因是_______________________________________________________
________________________________________________________________________。
(4)请填写表中的平均温度差:

(5)近似认为0.50 mol·L-1NaOH溶液与0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1,则上述实验测得的中和热=__________________(结果保留至小数点后一位)。
(6)上述实验测得中和热的数值小于57.3 kJ·mol-1,产生偏差的原因可能是________(填字母)。
A.量取NaOH溶液时仰视读数
B.为了使反应充分,向酸溶液中分次加入碱溶液
C.实验装置保温隔热效果差
D.用铜丝代替玻璃搅拌器搅拌
17.I、已知在298 K时的热化学方程式:2H2(g)+O2(g)===2H2O(l) ΔH1=-571.6 kJ·mol-1,CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH2=-890.3 kJ·mol-1,C(s)+O2(g)===CO2(g) ΔH3=-393.5 kJ·mol-1。根据上面的热化学方程式完成下列问题:
(1)通过计算说明等质量的H2、C、CH4完全燃烧时放出热量最多的是________。
(2)根据以上反应,则C(s)+2H2(g)===CH4(g)的焓变ΔH=________。
(3)已知H2O(l)===H2O(g) ΔH4=+44.0 kJ·mol-1,试写出甲烷燃烧生成二氧化碳和水蒸气的热化学方程式:____________________________________________________________
________________________________________________________________________。
Ⅱ、甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g) ![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
回答下列问题:
已知反应①中相关的化学键键能数据如下:
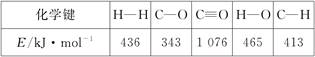
由此计算ΔH1=________kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3=________kJ·mol-1。
18.下图是一个电化学过程的示意图。请回答下列问题:
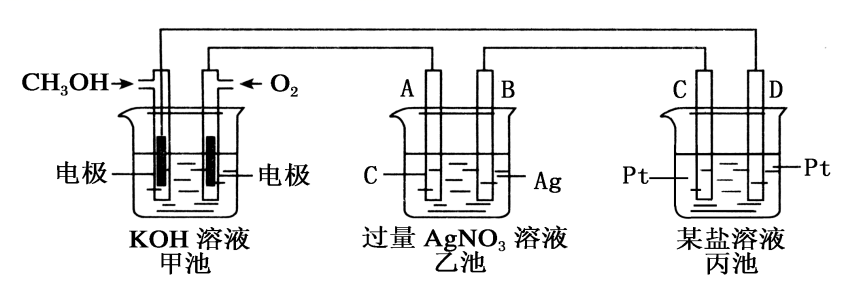
(1)图中甲池中OH−移向_________极(填“CH3OH”或“O2”)。
(2)写出通入CH3OH的电极的电极反应式:___________________
(3)A电极的名称是_____, 乙池中反应的化学方程式_____________。
(4)当乙池中B(Ag)极质量增加10.8 g,甲池中理论上消耗O2的体积为________L(标准状况),此时丙池中某电极析出某金属,则丙池中的某盐溶液可能是____________
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
19.某化学小组用下图装置电解CuCl2溶液制少量漂白液:
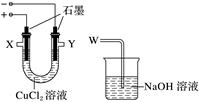
(1)其阳极的反应式是__________;导气管W端应与出气口________连接。
(2)实验后发现阴极碳棒上除了附着有红色物质,还附着有少量白色物质。
查阅资料显示:

化学小组分析提出:①红色物质可能有________或Cu2O或二者都有;②白色物质为CuCl
(3)为探究阴极碳棒上附着的红色、白色物质,设计了如下实验:
取出阴极碳棒,洗涤、干燥、称其质量为W1g,并将其放入下图所示装置b中,进行实验。
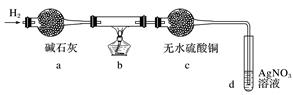
实验中,碳棒上的白色物质完全变为红色,无水硫酸铜不变色,d中出现白色沉淀;实验结束时,继续通H2直至碳棒冷却后,称量其质量为W2g。
①碳棒上的红色物质是________,无水硫酸铜的作用是________________________________。
②d中反应的离子方程式是_______________________________________________________。
③装置b中发生反应的化学方程式是__________________________________________。
④电解CuCl2溶液时,阴极上产生白色物质的原因为____________________________(用电极反应式解释)。
⑤阴极上产生白色物质的物质的量是________;若装置b冷却时不继续通H2,则计算所得Cu+的产率会________(填“偏大”、“偏小”或“不变”)。
20.某课外小组分别用下图所示装置对原电池和电解池原理进行实验探究。
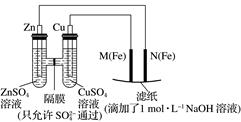
图1
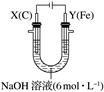
图2
请回答:
Ⅰ.用图1所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是________(填序号)。
A.铝B.石墨C.银D.铂
(2)N极发生反应的电极反应为________。
(3)实验过程中,________(填“从左向右”、“从右向左”或“不”)移动;滤纸上能观察到的现象有__________________。
Ⅱ.用图2所示装置进行第二组实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(Fe)在溶液中呈紫红色。
(4)电解过程中,Y极发生的电极反应为Fe-6e-+8OH-===Fe+4H2O和________________________________________________________________________。
(5)若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况下的气体体积),则Y电极(铁电极)质量减少________g。
(6)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应:2K2FeO4+3Zn===Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应为________________。