Hits: 135
@3.27周测试题
16.(12分)已知X、Y、Z、W、Q为短周期元素,它们具有如下特征:
|
元素 |
特征 |
|
X |
在元素周期表中,原子半径最小 |
|
Y |
最外层电子数是次外层电子数的两倍 |
|
Z |
常温下,有Z2、Z3两种气体单质存在 |
|
W |
与Z原子具有相同的最外层电子数 |
|
Q |
M层比K层少1个电子 |
回答下列问题:
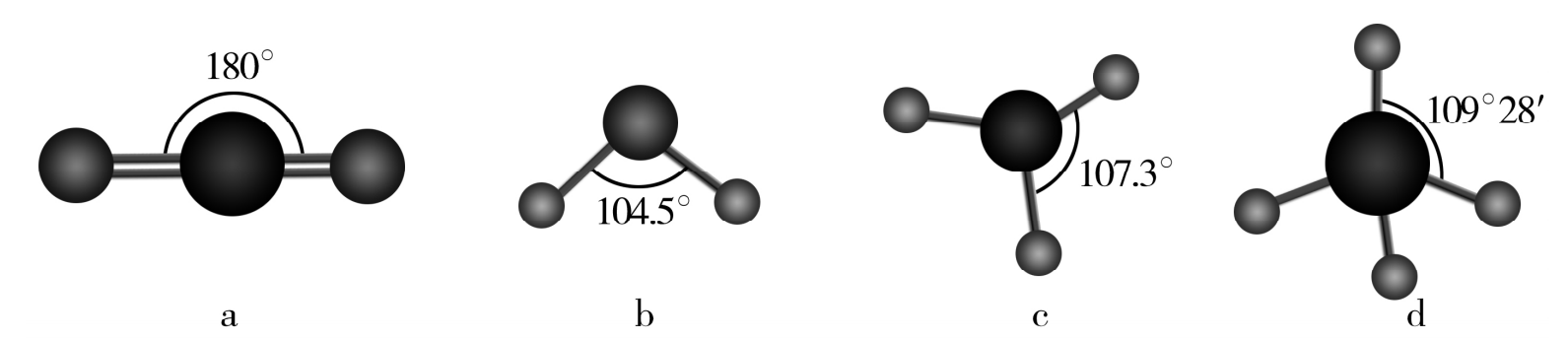
(1)下图模型表示的分子中,可由X、Y形成的是 (填写序号)。
(2)Q单质在Z单质中燃烧生成淡黄色固体,该固体中所含化学键类型为 。
(3)硒(Se)是人体必需的微量元素,与Z同主族,且比Z原子多两个电子层, 推测并画出Se的原子结构示意图 ; W和Se的简单气态氢化物的稳定性由大到小的顺序 (用氢化物化学式表示);SeO2具有刺激性气味,可与足量NaOH溶 液反应,离子方程式为 。
(4)设计实验证明W的得电子能力大于Y,简述操作步骤和现象(可选用试剂: 稀HNO3、稀H2SO4、稀盐酸、大理石、纯碱、澄清石灰水) o
17.(12分)为验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验 (夹持仪器已略去,气密性已检验)。
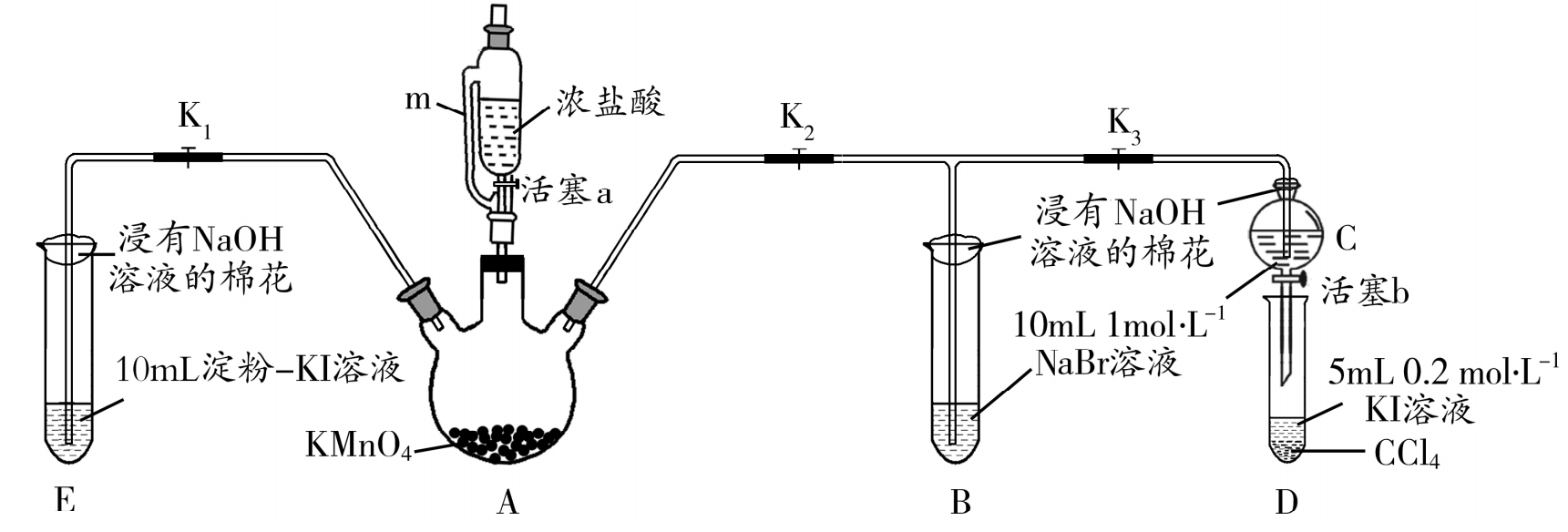
实验过程:
II关闭Ki,打开电,K3,当B和C中的溶液都变为黄色时,关闭K3。
III.B中继续通气体,当B中溶液由黄色变为棕红色时,关闭活塞a。
IV..…
回答下列问题:
(4)过程IV的目的是验证溴的氧化性强于碘,简述其操作过程 。
(6)请用原子结构的知识解释氯、溴、碘单质的氧化性逐渐减弱的原因 。
18.(12分)联氨(N2H4)是一种应用广泛的化工原料,常用作火箭和燃料电池的燃料。回答下列问题:
(1)工业上利用N2和H2合成NH3,用NH3进一步制备联氨(N2H4)。
①已知断开(或形成)1molN≡N键、H-H键分别需要吸收(或放出)948. 9kJ, 436.0kJ的热量,合成lmolNH3可放出46. 1kJ的热量,则形成1molN-H放出的热量为 kJ (保留一位小数)。
②工业上一种制备联氨的方法为NaClO +2NH3·H20 = N2H4 + NaCl+3H2Oo该反 应涉及物质中属于离子化合物的是 (填写化学式)。制备80 kg N2H4,反应中转移电子的物质的量为 molo
已知:
i .N2H4(g)的摩尔燃烧焰为-622kJ·moL-1。
ii. N2(g)与O2(g)反应的物质和能量变化示意图如下:
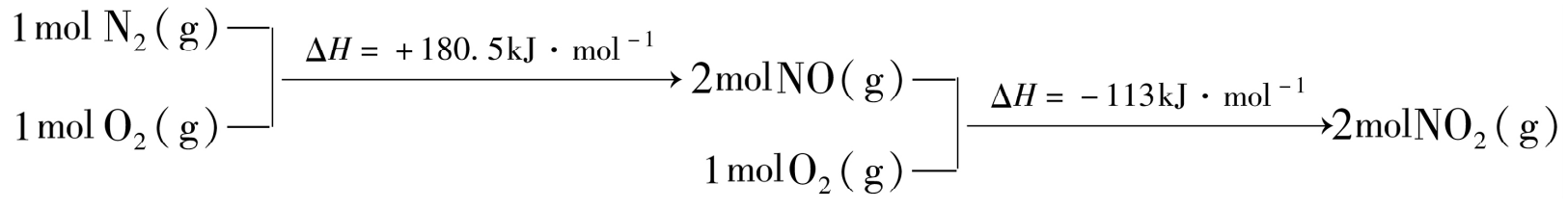
N2H4 (g)与NO2 (g)反应生成N2(g)和H2O(1)的热化学方程式为:( )
(3)一种联氨燃料电池的工作原理如图所示。放电一段时间,电解质溶液中OH- 的物质的量浓度 (填“增大” “减小”或“不变”),负极反应式为( )
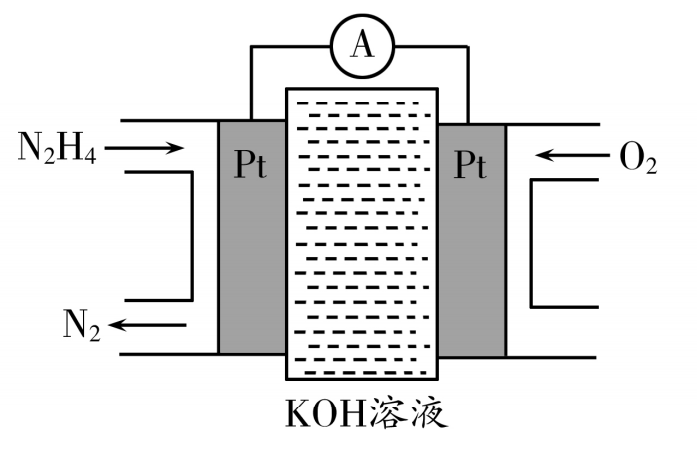
19.(12分)科学家研发了适用于火星大气(主要成分是CO2)的“Li-CO2”可充电电池,电池总反应为3CO2(g) +4Li(s) ![]() 2Li2CO3(s) + C(s),工作原理如图所示。
2Li2CO3(s) + C(s),工作原理如图所示。
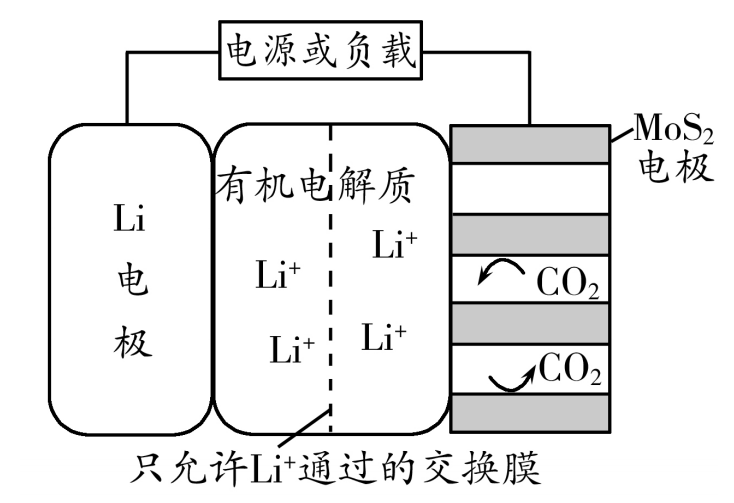
回答下列问题:
(1)放电过程中Li+由 ( )电极向( )电极迁移(填“Li”或“MoS2”);
正极反应式为: ( )
(2)已知:
2CO2(g) + 2Li(s) = Li2CO3(s) + CO(g) △H1=-539 kJ·mol-1
½CO2(g) + ½C(s) = CO(g) △H2 = +86 kJ·mol-1
充电过程总反应的热化学方程式为 ( )
(3)比能量是指消耗单位质量的电极反应物所释放的电量,是衡量电池优劣的重要指标,则Li、Mg、Al分别作为电极时比能量由大到小的顺序为( )
(4)放电一段时间,吸收标准状况下33.6LCO2,测得正、负极的质量变化分别为△m1g和△m2g假设有机电解质溶液的体积不变,则Li+的物质的量浓度 ( )(填写“增大”、“减小”或“不变”);理论上,△m1g-△m2g的值是 ( )g。
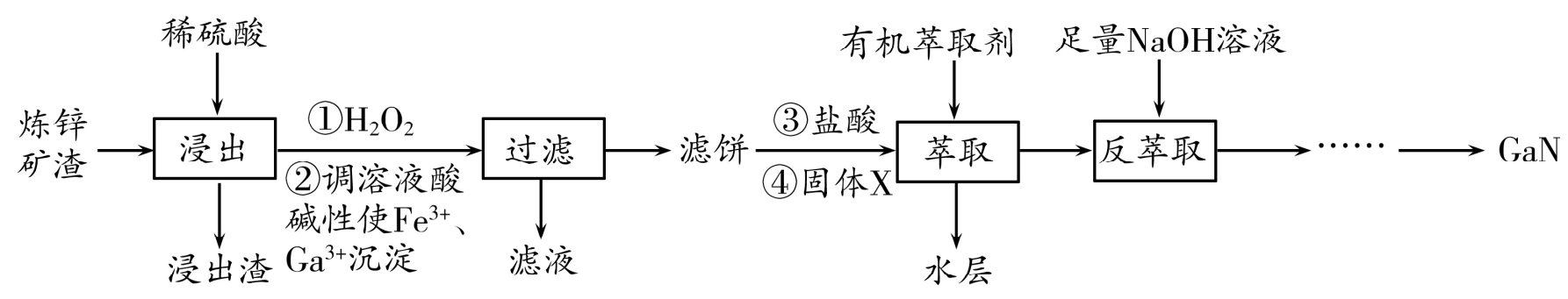
20. (12分)利用炼锌矿渣[主要含铁酸镓Ga2(Fe2O4)3、铁酸锌ZnFe2O4]可制得具有优异光电性能的氮化镓(GaN),部分工艺流程如下:
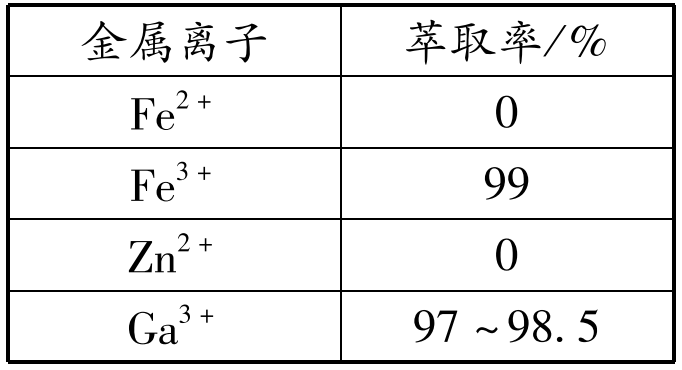
已知:金属离子在该工艺条件下的萃取率(进入有机层中的金属离子百分数)见下表
回答下列问题:
(1)ZnFe2O4可以写成ZnO·Fe2O3, “浸出”过程中ZnFe2O4发生反应的离子方程式为( )
(2)滤饼的主要成分是 ( )(填化学式),固体X最好选用 ( )(填化学式)。
(3)Ga与Al同主族,化学性质相似。“反萃取”后,溶液中傢元素的存在形式为( ) (填离子符号)。
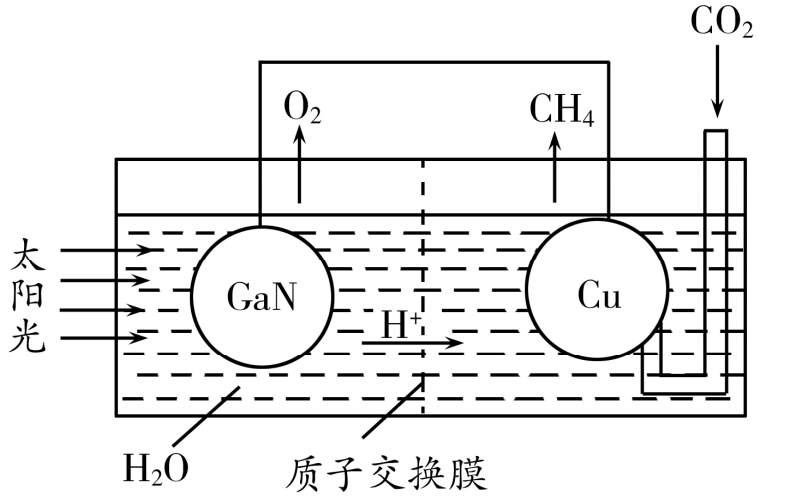
(4)下图表示氮化傢与铜组装成的人工光合系统的工作原理,铜电极上发生反应的电极反应式为( ) 。向该系统中通入标况下6.72LCO2,理论上可产生氧气的物质的量为( ) mol。